Забруднюючі речовини 4 класу небезпеки - Челябінський гідрометеоцентр
> моніторинг середовища > Забруднюючі речовини > Забруднюючі речовини 4 класу небезпеки
Оксид вуглецю (чадний газ).
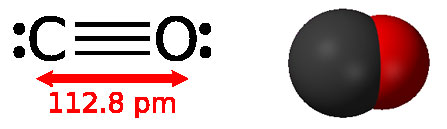
Оксид вуглецю - безбарвний газ, який не має запаху, трохи легший за повітря, погано розчинний у воді, має температуру кипіння: - 191,5 ° С. На повітрі загоряється при температурі 700 ° С і згорає синім полум'ям до СО2.
Джерела надходження в навколишнє середовище.
Монооксид вуглецю входить до складу атмосфери (10%). В атмосферу оксид вуглецю потрапляє в складі вулканічних і болотних газів, в результаті лісових і степових пожеж, виділення мікроорганізмами, рослинами, тваринами і людиною. З поверхневих шарів океанів в рік виділяється 220х106 тонн оксиду вуглецю в результаті фоторазложенія червоних, синьо-зелених та ін. Водоростей, продуктів життєдіяльності планктону. Природний рівень вмісту оксиду вуглецю в атмосферному повітрі - 0,01-0,9 мг / м3.
Чадний газ потрапляє в атмосферу від промислових підприємств, в першу чергу металургії. У металургійних процесах при виплавці 1 млн. Тонн сталі утворюється 320-400 тонн оксиду вуглецю. Велика кількість СО утворюється в нафтовій промисловості і на хімічних підприємствах (крекінг нафти, виробництво формаліну, вуглеводнів, аміаку та ін.). Ще одним важливим джерелом оксиду вуглецю є тютюновий дим. Висока концентрація оксиду вуглецю у вугільних шахтах, на углеподающіх трасах. Оксид вуглецю утворюється при неповному згорянні палива в печах і двигунах внутрішнього згоряння. Важливим джерелом оксиду вуглецю є автомобільний транспорт.
В результаті діяльності людини в атмосферу щорічно надходить 350-600х106 тонн чадного газу. Близько 56-62% цієї кількості припадає на частку автотранспорту (вміст оксиду вуглецю у вихлопних газах може досягати величини 12%).
Поведінка в навколишньому середовищі.
При звичайних умовах монооксид вуглецю інертний. Він хімічно не взаємодіє з водою. Розчинність СО у воді близько 1:40 за обсягом. У розчині здатний відновлювати солі золота і платини до вільних металів вже при звичайній температурі. Не реагує СО також з лугами і кислотами. Взаємодіє з їдкими лугами тільки при підвищених температурах і високому тиску.
Спад оксиду вуглецю в навколишнє середовище відбувається за рахунок його розкладання грунтовими грибами. Крім того, при надлишку кисню в грунтах важкого механічного складу, багатих органічними речовинами, має місце перехід СО в СО2.
Вплив на організм людини.
Оксид вуглецю надзвичайно отруйний. Допустимий вміст СО в виробничих приміщеннях становить 20 мг / м3 протягом робочого дня, 50 мг / м3 протягом 1 години, 100 мг / м3 протягом 30 хвилин, в атмосферному повітрі міста максимальна разова (за 20 хв) - 5 мг / м3 , середньодобова ГДК - 3 мг / м3. Природний рівень вмісту оксиду вуглецю в атмосферному повітрі - 0,01-0,9 мг / м3.
СО вдихається разом з повітрям і надходить у кров, де конкурує з киснем за молекули гемоглобіну. Оксид вуглецю, маючи подвійну хімічну зв'язок, з'єднується з гемоглобіном міцніше, ніж молекула кисню. Чим більше СО міститься в повітрі, тим більше молекул гемоглобіну зв'язується з ним і тим менше кисню досягає клітин організму. Порушується здатність крові постачати кисень до тканин, викликаються спазми судин, знижується імунологічна активність людини, що супроводжуються головним болем, втратою свідомості і смертю. З цих причин СО в підвищених концентраціях є смертельна отрута.
СО порушує фосфорний обмін. Порушення азотистого обміну викликає зотемію, зміна змісту білків плазми, зниження активності холінестерази крові і рівня вітаміну В6. Чадний газ впливає на вуглеводний обмін, посилює розпад глікогену в печінці, порушуючи утилізацію глюкози, підвищуючи рівень цукру в крові. Надходження СО з легких в кров обумовлено концентрацією СО у вдихуваному повітрі і тривалістю інгаляції. Виділення СО відбувається головним чином через дихальні шляхи.
Найбільше при отруєнні страждає ЦНС. При вдиханні невеликій концентрації (до 1 мг / л) - тяжкість і відчуття здавлювання голови, сильний біль на чолі і скронях, запаморочення, тремтіння, спрага, збільшення частоти пульсу, нудота, блювота, підвищення температури тіла до 38-40 ° С. Слабкість в ногах свідчить про поширення дії на спинний мозок.
Надзвичайна отруйність СО, відсутність у нього кольору і запаху, а також дуже слабке поглинання його активованим вугіллям звичайного протигаза роблять цей газ особливо небезпечним.
Клас небезпеки речовини - 4.
Аміак.
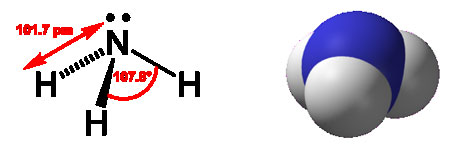
Аміак - безбарвний газ з різким запахом, температура плавлення - 80 ° С, температура кипіння - 36 ° С, добре розчиняється у воді, спирті і ряді інших органічних розчинників. Синтезують з азоту і водню. У природі утворюється при розкладанні азотовмісних органічних сполук.
Знаходження в природі.
У природі утворюється при розкладанні азотовмісних органічних сполук.
Різкий запах аміаку відомий людині з доісторичних часів, так як цей газ утворюється в значних кількостях при гнитті, розкладанні і сухій перегонці містять азот органічних сполук, наприклад сечовини або білків. Не виключено, що на ранніх стадіях еволюції Землі в її атмосфері було досить багато аміаку. Однак і зараз невелику кількість цього газу завжди можна виявити в повітрі і в дощовій воді, оскільки він безперервно утворюється при розкладанні тваринних і рослинних білків.
Антропогенні джерела надходження в навколишнє середовище.
Основними джерелами виділення аміаку є азотнотуковий комбінати, підприємства з виробництва азотної кислоти і солей амонію, холодильні установки, коксохімічні заводи і тваринницькі ферми. У районах техногенного забруднення концентрації аміаку досягають величин 0,015-0,057 мг / м3, в контрольних районах - 0,003-0,005 мг / м3.
Вплив на організм людини.
Цей газ токсичний. Людина здатна відчути запах аміаку в повітрі вже в незначній концентрації - 0,0005 мг / л, коли ще немає великої небезпеки для здоров'я. При підвищенні концентрації в 100 разів (до 0,05 мг / л) проявляється подразнюючу дію аміаку на слизову оболонку очей і верхніх дихальних шляхів, можлива навіть рефлекторна зупинка дихання. Концентрацію 0,25 мг / л насилу витримує протягом години навіть дуже здорова людина. Ще більш високі концентрації викликають хімічні опіки очей та дихальних шляхів і стають небезпечними для життя. Зовнішні ознаки отруєння аміаком можуть бути досить незвичайними. У постраждалих, наприклад, різко знижується слуховий поріг: навіть не дуже гучні звуки стають нестерпні і можуть викликати судоми. Отруєння аміаком викликає також сильне збудження, аж до буйного марення, а наслідки можуть бути дуже важкими - до зниження інтелекту і зміни особистості. Очевидно, аміак здатний вражати життєво важливі центри, так що при роботі з ним треба ретельно дотримуватися запобіжних заходів.
Хронічний вплив сублетальлними доз аміаку призводить до вегетативних розладів, підвищення збудливості парасимпатичного відділу нервової системи, скарги на слабкість, нездужання, нежить, кашель, біль у грудях.
Клас небезпеки речовини - 4.
"назад"